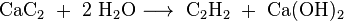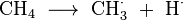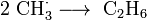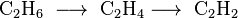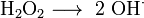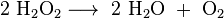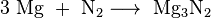Enkele producten van Electrozuur
bron

Carbid
Calciumcarbide (ook bekend onder de benamingen carbid, karbiet of carbuur) is een anorganische verbinding van calcium en koolstof, met als brutoformule CaC2. De stof komt voor als een witgeel tot grijsblauw kristallijn poeder of als brokken. Formeel is calciumcarbide het calciumzout van ethyn.
Calciumcarbide kan bereid worden door calciumoxide (ongebluste kalk) met koolstof (cokes) te verhitten tot een temperatuur van 2000°C:
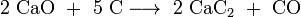
- Productie van ethyn
Calciumcarbide ontleedt met water onder vorming van ethyn (acetyleen):
Deze hydrolyse van calciumcarbide was tot in de jaren ’30 van de 20e eeuw de enige methode om ethyn te produceren. Hierdoor was calciumcarbide een belangrijk uitgangspunt bij de ontwikkeling van de acetyleenchemie (de chemie van Walter Reppe).[1] Met de opkomst van de petrochemische industrie heeft deze methode sterk aan belang verloren.
Ethyn is op zijn beurt weer een grondstof voor een groot aantal andere verbindingen, waaronder het polymeer polyacetyleen. Dit is een geleidend polymeer.
Tussen 1900 en 1945 werd calciumcarbide veel gebruikt in de carbidlamp, onder andere om voertuigen (zoals auto of fiets) te voorzien van verlichting. In een carbidlamp zit een waterreservoir waaruit, na een nauwkeurige en lastige afstelling, water op het carbid druppelt en ethyn ontstaat. Het ethyngas verbrand vervolgens met een vlam die een helder wit licht geeft. Na 1945 is de carbidlamp vrijwel geheel verdrongen door elektrische verlichting. Voor de komst van ethyn in gasflessen werd carbid door smeden gebruikt als brandstof voor lasbranders.
Acetyleen
Ethyn of acetyleen is het eenvoudigste alkyn. Ethyn is een lineair molecuul met een inversiepunt. Het behoort tot puntgroep D∞h.
Ethyn werd in 1836 ontdekt door de Britse scheikundige Edmund Davy, maar is daarna enigszins in vergetelheid geraakt totdat Marcellin Berthelot het herontdekte in 1860 en er toen de naam acetyleen aan gaf.
Ethyn waaraan één waterstofatoom is onttrokken is het eenvoudigste voorbeeld van een alkynylgroep, de benaming voor een functionele groep als de nadruk gelegd moet worden op de interactie tussen de drievoudige binding en de eraan gekoppelde substituent.
Het kan in een laboratorium worden bereid door langzaam water op calciumcarbide te druppelen:
Een tweede mogelijkheid om ethyn te produceren is door de pyrolyse van methaan bij een temperatuur hoger dan 1400°C. Doordat dehydrogenering van alkanen rond 700 – 900°C al gebeurt, wordt uit het geproduceerde ethaan snel etheen gevormd dat bij nog hogere temperatuur waterstof verliest.
[bewerken] Eigenschappen
Ethyn is een reactief gas met zeer brede explosiegrenzen in mengsels met lucht, wat wil zeggen dat het in een breed concentratiegebied, van 2,5% – 82%, met lucht een explosief mengsel vormt. Voor autogeen lassen wordt het meestal vervoerd in hogedrukcilinders waarbij het is opgelost in aceton omdat het in zuivere toestand spontaan kan exploderen als het tot meer dan ca. 30 atmosfeer wordt samengeperst. Dit omdat de ontledingsreactie exotherm verloopt, zelfs in afwezigheid van lucht of zuurstof.
[bewerken] Toepassingen
Ethyn wordt samen met zuivere zuurstof gebruikt in apparatuur voor autogeen lassen vanwege de bijzonder hete vlam. Daarnaast wordt het gebruikt als brandergas, onder andere bij een inductief gekoppeld plasma.
Het is een belangrijke grondstof voor een aantal industriële stoffen, waaronder vinylchloride, neopreen en acrylonitril, die worden gebruikt bij de vervaardiging van kunststoffen.
[bewerken] Toxicologie en veiligheid
Door de brede explosiegrenzen is ethyn zeer explosiegevaarlijk. Het kan zeer exotherm reageren met tal van verbindingen, waaronder elektrofielen.
Loodwit
Loodwit is een loodverbinding (basisch lood(II)carbonaat 2PbCO3·Pb(OH)2) die als wit pigment wordt gebruikt. Door de hoge giftigheid wordt het nog nauwelijks gebruikt. De verkoop van loodwit in tubes is in het gebied van de Europese Unie verboden.
Op ambachtelijke wijze wordt loodwit verkregen door banden lood van een 10 à 15 cm breed en een goede meter lang, op te rollen. De lagen mogen elkaar nochtans niet raken. Tussen elke laag moet een ruimte van ongeveer twee millimeter behouden worden. De opgerolde banden lood, vergelijkbaar met een veer, worden in aarden potten waarvan de bodem gevuld is met azijnzuur gehangen. Het lood mag echter niet in aanraking komen met het zuur. De aarden potten worden op hun beurt in paardenmest geplaatst zodat de warmte van de mest de salpeterdampen doet neerslaan op het lood. De reactie van de dampen op het lood geeft loodwit dat van de banden wordt geschraapt en vermengd wordt met lijnolie om direct als olieverf bruikbaar te zijn.
Het alzo verkregen loodwit is steviger van structuur en behoudt gemakkelijker de toets van borstel of paletmes. De beste kwaliteit heet cremserwit.
Loodwit was tot het midden van de 19e eeuw, toen het aangevuld werd door zinkwit, het belangrijkste witte pigment, zowel in de schilderkunst, als bij de make-up. Ondanks zijn giftigheid werd het in de Oudheid ook gebruikt als conserveringsmiddel en zoetstof in levensmiddelen. Het schildertechnisch belang werd nog vergroot doordat loodwit bij olieverf door reactie met het bindmiddel lijnolie loodzepen vormt, die weliswaar bros zijn maar ook zeer hard zodat de levensduur van de schilderijen zeer wordt verlengd. Moderne olieverfschilderijen zonder loodwit zullen de eeuwen niet doorstaan. Omdat loodwit röntgenstralen goed tegenhoudt, maakt het de moderne onderzoeker mogelijk eerdere opzetten van het schilderij zichtbaar te maken.
Azijnzuur
Azijnzuur (systematische naam ethaanzuur) is een zwak zuur met een kenmerkende stekende geur. Het heeft als formule CH3-COOH (soms ook geschreven als H3C-COOH). Azijnzuur is, na mierenzuur, het eenvoudigste carbonzuur en de wetenschappelijke naam was vroeger dan ook methaancarbonzuur. Zuiver watervrij azijnzuur wordt ook wel ijsazijn genoemd, en is een kleurloze vloeistof die bij temperatuur lager dan 17 °C stolt tot heldere kleurloze kristallen (vandaar de naam ijsazijn). Indien ijsazijn in een (trillingvrije) koelkast wordt geplaatst, kan het tot beneden het stolpunt worden gekoeld terwijl het toch een vloeistof blijft. Het is dan een onderkoelde vloeistof geworden, en een geringe fysieke verstoring doet de vloeistof dan direct stollen.
In het menselijk lichaam komt azijnzuur voornamelijk gebonden aan het Co-enzym A (CoA) voor, een stof die uitermate belangrijk is voor vele biochemische processen. Daarnaast vormt azijnzuur met choline de ester acetylcholine, een zeer veel voorkomende en belangrijke neurotransmitter. Het azijnzuur dat bij de biochemische processen vrijkomt, wordt doorlopend hergebruikt. Daarnaast komt azijnzuur voor in bepaalde bacteriën, in sommige planten en vele vruchten.
Het bereiden van azijn als voedingsmiddel werd vroeger gedaan door alcohol te laten fermenteren. Wijnazijn is daar een mooi voorbeeld van, maar ook de huidige tafelazijn wordt gemaakt van alcohol.
Voor industrieel gebruik zijn er andere synthesemethodes:
- Uit methanol en koolstofmonoxide wordt azijnzuur gemaakt met behulp van een katalysator (kobalt-, rhodium– of indiumverbindingen) bij circa 180 °C en onder hoge druk (30 tot 40 atmosfeer). Dit proces (het Monsanto-proces) is wereldwijd het meest gebruikt voor de productie van azijnzuur. De omzetting tot azijnzuur is zeer hoog (ca. 99%).
- Uit aceetaldehyde door oxidatie aan de lucht met behulp van een katalysator (mangaan-, kobalt en chroomzouten).
- Uit butaan door oxidatie aan de lucht met behulp van een katalysator (mangaan, kobalt en chroomzouten) en onder verhoogde temperatuur.
Industrie
Zuiver azijnzuur is een belangrijke grondstof in de polymeerchemie waarbij celluloseacetaat en polyvinylacetaat gemaakt worden voor onder meer synthetische vezels, plastics en lijmen. Azijnzuuranhydride is daarin een belangrijke tussenstof. Ook acetaten (azijnzure zouten) zijn belangrijke eindproducten.
Met alcoholen vormt azijnzuur esters die als oplosmiddel of geurstof gebruikt worden.
[bewerken] Voeding
Azijnzuur en sommige acetaten worden gebruikt als smaakstof, conserveermiddel of zuurteregelaar in de voedingsmiddelen industrie. Dit zijn:
- E 260 – Azijnzuur
- E 261 – Kaliumacetaat
- E 262 – Natriumacetaat
- E 263 – Calciumacetaat
Azijn is een oplossing van 4 tot 15% azijnzuur in water. Azijn wordt weer gebruikt bij het inmaken van groentes en de bereiding van diverse sauzen, zoals mosterd.
Schellak
Schellak is een type was dat vele toepassingen kende en nog kent. Het werd onder meer gebruikt voor het vervaardigen van lakzegels, als afdichtingsmiddel in de houtbewerking en voedingsnijverheid, bij het maken van hoeden en watervaste inkten en als isolatielaagje voor koperdraad van transformatoren en smoorspoelen. Het wordt nog steeds gebruikt als basis voor de waslaag die op citroenen gespoten wordt en in de farmaceutische industrie.
De grondstof wordt gewonnen als het harsachtige afscheidingsproduct van de kleine lakschildluis (Coccus lacca of de commercieel gekweekte soort Laccifer lacca), een boomluis die voornamelijk voorkomt op diverse boomsoorten in India en omringende landen. De schellak wordt van de boomtakken geschraapt en gedroogd. Eventueel wordt het gefilterd door het te verwarmen en door een doek van bijvoorbeeld jute te laten lekken. Het wordt verhandeld in tabletten of schilfers in verscheidene kleurgradaties van blond (gezuiverd) tot donker. Bij verwerking is het op zich niet giftig, maar de alcohol waarin het opgelost wordt, kan dat wel zijn.
Schellak is een thermoplastisch materiaal, wat wil zeggen dat het zacht wordt bij verwarming. In gesmolten toestand kan schellak vermengd worden met een vulmateriaal (zoals houtpoeder of een minerale vulstof) en onder invloed van druk en temperatuur in een vorm geperst worden.
[bewerken] Toepassingen
Sinds de tweede helft van de 16e eeuw werd schellak gebruikt voor het vervaardigen van lakzegels. De schellak werd door de Portugezen vanuit Oost-Indië naar Europa meegebracht en de zegellak werd daarom ook wel Spaanse was genoemd. Vóór die tijd werden zegels namelijk bijna altijd vervaardigd van was.
In de negentiende eeuw werden van schellak op deze manier allerlei voorwerpen gemaakt, in de beginperiode van de fotografie bijvoorbeeld kaders om Daguerreotypieën en ambrotypes in te plaatsen. Later werden verschillende mineralen als vulstof aan de schellak toegevoegd om de eigenschappen te veranderen. Zo werden tot circa 1959 de 78 toerengrammofoonplaten geperst, deze waren echter wel erg breekbaar.
Schellak (stoklak) is het hoofdbestanddeel in politoer en wordt ook gebruikt om beukenhout te bewerken, zodat het geschikt is als isolatiesteun in elektrische schakelborden en dan resarm wordt genoemd. Het werd ook wel gebruikt als isolatiemateriaal voor elektriciteitsdraden. Een voorbeeld is een transformator, waarbij de draad strak moet worden opgewikkeld met een zo dun mogelijke afscheiding ertussen. Hiervoor werd schellak gebruikt omdat het ook in kleine hoeveelheden al een zeer goede elektrische isolatie biedt.
Fossielen verbrokkelen soms door blootstelling aan lucht, temperatuurveranderingen en vochtigheid. Om ze hiertegen te beschermen, kunnen ze gedrenkt worden in een mengsel van alcohol en schellak, waarna ze een bruine kleur krijgen. Een voorbeeld hiervan zijn de Iguanodons van Bernissart, die staan opgesteld in het Koninklijk Belgisch Instituut voor Natuurwetenschappen in Brussel.
In de horloge-industrie wordt schellak onder andere gebruikt voor het fixeren van de ankerstenen op het anker, terwijl bij blaasinstrumenten de polsters in de kleppen worden gemonteerd met behulp van schellak.
In voedingsmiddelen is het bekend als E904: glansmiddel. Het wordt toegepast als waxcoating bij vruchten, bonbons en suikergoed.
In de farmaceutische industrie wordt het gebruikt om medicijnen maagzuur-resistent te maken en geschikt te maken voor vertraagde afgifte van de capsule-inhoud.
Metaldehyde
Metaldehyde is een cyclisch ether met als brutoformule C8H16O4. Het is het cyclisch tetrameer van aceetaldehyde.
Metaldehyde kan bereid worden door middel van een cyclisatie van 4 equivalenten aceetaldehyde, met zwavelzuur als katalysator. Deze reactie is zeer temperatuurgevoelig: rond -10°C wordt metaldehyde gevormd, terwijl bij kamertemperatuur het trimeer paraldehyde ontstaat.
Metaldehyde wordt gebruikt in slakkenkorrels als slakkendodende stof (molluscicide). De technische stof die in deze korrels wordt gebruikt bevat ook nog hogere oligomeren van aceetaldehyde. Er zijn vele middelen op de markt, onder andere Metald-Slakkenkorrels (Bayer), Caragoal GR (Certis) en Luxan Slakkenkorrels. Deze producten bevatten ongeveer 6 à 6,5 gewichtsprocent metaldehyde. Daarnaast bevatten ze ook een afweermiddel, om te vermijden dat kinderen of huisdieren de korrels zouden opeten. Dit middel is meestal Bitrex (denatoniumbenzoaat). Bitrex is een zeer bittere stof die ook aan huishoudelijke producten wordt toegevoegd om te voorkomen dat kinderen die zouden inslikken.
Metaldehyde werd oorspronkelijk gebruikt in vaste brandstoftabletten (vaste spiritus) voor draagbare kacheltjes; het brandt net als spiritus met een blauwe vlam en zonder rook. Het vlampunt ligt bij ca. 36-40°C. Vaak werd de naam dan ingekort tot meta.
Waterstof
Waterstofperoxide is een anorganische verbinding van waterstof en zuurstof, met als brutoformule H2O2. Het werd in 1818 ontdekt door Louis Jacques Thénard. Doorgaans wordt het commercieel verhandeld als oplossing in water.
Waterstofperoxide werd voor het eerst geproduceerd in het Verenigd Koninkrijk door bariumzouten te verbranden, waardoor bariumperoxide (BaO2) ontstaat. Dit wordt vervolgens opgelost in water, waardoor waterstofperoxide ontstaat. Een andere manier is via elektrolyse en via een autoredoxreactie met water.
Het meest gebruikte proces is tegenwoordig het zogenaamde antrachinon– of Riedl-Pfleiderer-proces, dat voor het eerst werd toegepast in de Tweede Wereldoorlog door I.G. Farbenindustrie in Duitsland. Hierbij wordt een antrachinonderivaat katalytisch met waterstofgas omgezet in het corresponderende hydrochinon. Dat wordt daarna met zuurstofgas of met zuurstofrijke lucht geoxideerd, waarbij opnieuw het oorspronkelijke antrachinonderivaat ontstaat samen met waterstofperoxide:
Structuur en eigenschappen
De molecule heeft één zuurstofatoom meer dan het veel stabielere water. De binding tussen de twee zuurstofatomen, de zogenaamde peroxidebinding, laat vrij makkelijk los, onder vorming van twee OH-radicalen:
Omdat deze radicalen makkelijk reageren met andere zuurstofradicalen (tot zuurstofgas) of met andere stoffen, onder vorming van nieuwe radicalen en zo een soort kettingreactie kunnen ontketenen, is een oplossing van waterstofperoxide uiterst reactief.
[bewerken] Toepassingen
Waterstofperoxide wordt onder andere gebruikt als ontsmettingsmiddel, bijvoorbeeld bij ontstekingen in de mondholte, ontsmetting van drinkwater, als bleekmiddel bijvoorbeeld bij het bleken van stoffen, tanden, botten en haar (blonderen).
Dit ontsmettende en blekende vermogen wordt veroorzaakt door de oxiderende werking van waterstofperoxide. Om deze reden wordt waterstofperoxide veel gebruikt in laboratoria en bij de productie van sommige organische stoffen.
Vermengd met andere chemicaliën werd het gebruikt als een van de zuurstofleverende middelen bij de voortstuwing van het Duitse Messerschmitt Me 163 Komet raketvliegtuig uit de Tweede Wereldoorlog. De ramp met de Russische kernonderzeeboot Koersk is waarschijnlijk veroorzaakt door het lekken van een waterstofperoxidetank in een torpedo.
In de handel zijn oplossingen met een sterkte van 30% en 3% verkrijgbaar. Sterkere oplossingen kunnen worden bereid, maar zijn potentieel explosief en dienen daarom met uiterste voorzichtigheid te worden behandeld.
[bewerken] Ontleding
Waterstofperoxide is erg reactief, maar ook onstabiel. Het zal na verloop van tijd ontleden in water en zuurstofgas via een auto-redoxreactie:
Deze reactie is spontaan, maar verloopt kinetisch gezien zeer traag. Ze kan versneld worden door de temperatuur te verhogen of met behulp van katalysatoren, zoals mangaan(IV)oxide, kaliumpermanganaat, zilver of het enzym katalase.
Zuurstof
zuurstof door elektrolyse van water
Hoge-drukelektrolyse is de elektrolyse van water door de ontleding van water (H2O) in zuurstof (O2) en waterstofgas (H2) onder druk. Het verschil met een standaard polymeer electroliet membraan electrolyzer is de gecomprimeerde waterstofproductie op ongeveer 120-200 Bar (1740-2900 psi)[1]. Door de druk van het waterstof in het elektrolyseapparaat is er geen externe waterstofcompressor nodig, het gemiddelde energieverbruik voor interne differentiële drukcompressie is ongeveer 3%
Chloorzink
Zinkchloride
Zinkchloride is een verbinding van de elementen zink en chloor.
In zuivere vorm is het een kleurloze of witte vaste stof. De stof is erg hygroscopisch en bijzonder goed in water oplosbaar. Er zijn een viertal kristallijne modificaties bekend (α-, β-, γ- en δ-ZnCl2). Daarvan treedt echter alleen de δ-ZnCl2 fase op als het materiaal echt watervrij is. Al deze structuren zijn gebaseerd op een tetraëder van chloor atomen rond een centraal zink atoom, maar de rangschikking van de tetraëders verschilt. Bij de aanwezigheid van sporen vocht worden ook de andere vormen aangetroffen, de kleur wordt dan licht geel. δ-ZnCl2 smelt bij 317°C, bij voldoend snel afkoelen vormt de stof een doorzichtig glas.
Zinkchloride is een vrij sterk Lewis-zuur. In de organische chemie wordt het vermengd met geconcentreerd zoutzuur gebruikt voor de omzetting van alcoholen in chlorides.

Stikstof
Distikstof of moleculaire stikstof (N2) is de belangrijkste enkelvoudige stof van het element stikstof. Het is onder normale druk en temperatuur een kleurloos, reukloos, smaakloos en inert gas. Het wordt ook wel stikstofgas genoemd. Distikstof maakt 78,06 % van het volume en 75,5 % van de massa van de aardatmosfeer uit.
Het gas bestaat uit twee-atomige moleculen N2 met een drievoudige binding, die de molecule een bijzonder grote stabiliteit verleent. Het is daarom relatief inert, maar kan via het Haber-Boschproces tot ammoniak (NH3) en via het Ostwaldproces tot salpeterzuur (HNO3) omgezet worden. Hiervoor zijn telkens katalysatoren nodig. De stikstofbinding kan door elektrische ontlading (bliksem) of door micro-organismen (stikstoffixatie) gemaakt worden en is van belang voor de vruchtbaarheid van landbouwgronden.
De vloeistof kookt bij 77K; bij 63K vormt zich een vaste stof, waarin echter nog steeds de moleculaire N2 structuur te herkennen valt. Vloeibare stikstof kent vele toepassingen in de industrie.
Bij zeer hoge drukken echter (ongeveer 240 GPa) vormt zich een halfgeleidende modificatie met waarschijnlijk een netwerkstructuur. Onder deze omstandigheden gedraagt het element zich dus meer als de andere leden van de stikstofgroep.
De drievoudige binding in stikstofgas is een van de sterkere in de natuur en het kost dan ook erg veel energie deze binding te verbreken (meer dan 900 kilojoule per mol). Omgekeerd komt er erg veel energie vrij als de binding gemaakt wordt. Dit is de reden dat in talloze explosieven stikstofbindingen te vinden zijn: als de stikstofgroepen uit deze stoffen vrijkomen, vormen zij onmiddellijk stikstofgas waarbij veel energie onder de vorm van warmte vrijkomt. Dit leidt tot een enorme volume- en temperatuursverhoging. Een voorbeeld is de explosieve ontleding van nitroglycerine of 2,4,6-trinitrotolueen (TNT).
Stikstofgas is matig tot slecht oplosbaar in water, maar bij hoge drukken neemt de oplosbaarheid toe. Dit veroorzaakt problemen voor duikers, de caissonziekte. Wanneer zij niet langzaam genoeg naar het oppervlakte terugkeren, ontstaan er stikstofbelletjes in het bloed die embolieën kunnen veroorzaken.
Stikstofgas reageert zelf niet gemakkelijk met andere elementen. Magnesium is daar een uitzondering op. Wanneer dit metaal eenmaal ontstoken is, brandt het ook in pure distikstof door onder de vorming van magnesiumnitride:
In dit geval treedt het element dus op als de redelijk sterke oxidator die het potentieel is. Ook lithium reageert op dezelfde manier met distikstof.
LITHOPONE
LITHOPONE CI PW 5 – 77115
Lithopone bestaat uit zinksulfide en bariumsulfaat.
De kwaliteit van de lithopone stijgt met het zinksulfide gehalte.
Lithopone is UV bestendig en heeft een goede kleurkracht en dekvermogen.
LIthopone is alkalibestendig, maar niet zuurbestendig.
lithopone voor kunstschilders